| 所属 |
① 東北大学 未来型医療創成センター ② 東北大学 大学院生命科学研究科 ③ 東北大学 多元物質科学研究所 |
|
|---|---|---|
| 氏名 |
① 小柴 生造 ② 田中 良和 ③ 稲葉 謙次 |
|
| AMED 事業 |
課題名 | ゲノム・オミックス・タンパク質構造情報を活用したアカデミア発の創薬支援 |
| 代表機関 | 東北大学 | |
| 代表者 | 山本 雅之 | |
クライオ電子顕微鏡、単粒子解析、クライオ電顕データ取得、構造解析
本支援では、東北大学・未来型医療創成センターにAMED・BINDSの支援の元に設置されたクライオ専用の300kVハイエンド透過型電子顕微鏡 日本電子社製CRYO ARM 300 IIを活用し、グリッド作成から構造解析にいたるクライオ電子顕微鏡による構造解析全般の技術支援を行う(下図)。また本学東北メディカル・メガバンク機構に設置されているスーパーコンピュータを活用してクライオ電子顕微鏡の膨大なデータをハイスループットに解析できる最先端の解析環境を提供する。また、化合物スクリーニングで得られたヒット化合物について、SBDD(Structure-based drug design)のための支援を行うとともに、対象分子の性質によってはNMRやX線結晶構造解析による構造解析支援も検討する。
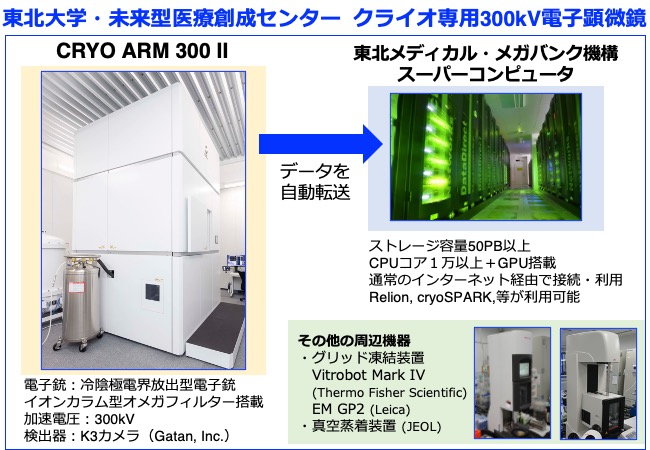
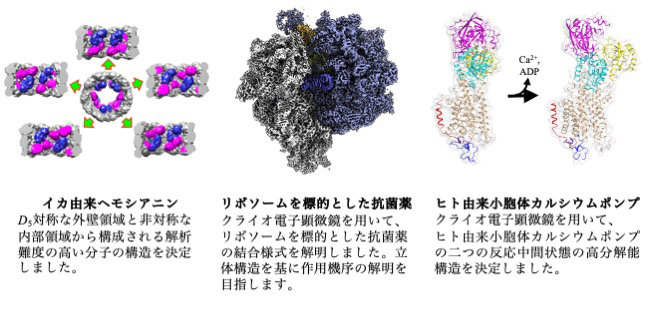
令和2年度末にAMED・BINDSの支援により、東北大学・未来型医療創成センターにクライオ専用の300kVハイエンド透過型電子顕微鏡が新たに導入された。そして令和3年9月よりAMED・BINDSの構造解析支援を開始しており、支援開始から半年で既に12件を超える支援を進めている(下図)。支援に際しては、グリッド作成、データ収集から構造解析まで様々なコンサルティングや支援をする。特に単粒子解析を中心とした構造解析支援を行うとともに、東北大メディカル・メガバンク機構が掲げる個別化医療と連携して高度化を進める。
小柴研究室
本研究室が所属する東北大学・未来型医療創成センターでは、次世代医療の実現に向けて様々な取り組みを進めている。本センターは本学の10部局(医学系研究科、大学病院、薬学研究科、生命科学研究科、東北メディカル・メガバンク機構など)が連携して進めている組織で、幅広い分野の研究者が研究を実施している。その中で本研究室は、クライオ電子顕微鏡を用いて疾患に関わる各種タンパク質の立体構造・機能解析を行うと共に、化合物スクリーニング等の研究者と連携して創薬にむけた取り組みを進めている。また、一般人の健康調査を実施している本学東北メディカル・メガバンク機構と連携して、同機構の全ゲノム解析が明らかにしたヒトのゲノムに存在する膨大な変異について、タンパク質の立体構造情報やメタボローム等の各種オミックス解析情報を活用してその影響を明らかにすることを目指している。また本研究室はクライオ電子顕微鏡の他にも、高感度高磁場溶液NMR装置(800&600MHz)や、LC-MS、GC-MS等の各種質量分析装置(Thermo Fisher Scientific, Waters, 島津)等を運用しており、各種分析に対応している。
メンバーのうち七谷圭は、トランスポーターをはじめとする膜タンパク質の発現・精製・生化学的解析・クライオ電子顕微鏡単粒子解析の実績がある。そのなかでタンパク質の発現、精製、クライオ電子顕微鏡観察からデータ解析まで広く経験している。特に、新規タンパク質の構造解析に重要であるタンパク質の安定条件の探索に関する多くの経験を有し、その成果を生かして最適化したタンパク質についてクライオ電子顕微鏡を用いた構造決定を行った。このため精製から電子顕微鏡データの解析まで幅広い支援が可能である。
また井上仁は、これまでタンパク質について生化学的解析及びNMRによる構造生物学的解析の経験があり、そのなかで様々なタンパク質の調製を経験している。また現在は、疾患に関連する各種代謝酵素について、クライオ電子顕微鏡による構造解析を中心とした研究を行っており、電子顕微鏡による測定からデータ解析までの経験も有する。
以上のこれまでの研究実績に基づき、小柴・七谷・井上班では、タンパク質の発現・精製から、クライオ電子顕微鏡による測定、さらには得られたデータの解析まで一連の構造解析に関する支援を行うことができる。また対象分子の性質によってはNMRによる解析支援も可能である。
田中研究室
田中良和はこれまで、毒素をはじめとした疾患に関連するタンパク質や、セントラルドグマ・酸素運搬など生命の根幹をなす重要なタンパク質の構造機能解析に取り組んできた(Tanaka et al., JBC 2007; Tanaka et al, Structure 2008; Tanaka et al., RNA 2009; Yamashita et al., PNAS 2011; Yu et al., PNAS 2011; Yamashita et al., Nat. Commun. 2014; Gai et al., Structure 2015; Chen et al., PNAS 2017; Chen et al., Commun. Biol.; Tanaka et al., IUCrj 2019; Wakui et al., Chem. Sci. 2020 etc)。クライオ電顕だけでなくネガティブ染色法による電子顕微鏡単粒子解析の実績もある(Chen et al., Nat. Commun. 2017; Makabe et al., Sci. Rep. 2021; Ghanem et al., FEBS J. 2022 et al)。最近は、膜蛋白質のクライオ電顕単粒子解析でも成果を上げつつあるほか、海洋天然物からの有用分子の取得とそれを利用した創薬研究にも取り組んでいる(特願2022-013983)。
横山武司は、これまで翻訳に関わる複合体を中心にクライオ電子顕微鏡を用いた構造解析を進めてきた(Yokoyama et al., Mol Cell 2019, Fujita et al., RNA 2021; Kashiwagi et al., Science 2019)。また、クライオ電顕施設でのファシリティーの管理維持を通して多様な試料の構造解析に関わってきた(Kasuya et al., Nat Struct Mol Biol 2018; Ehara et al., Science 2017; Lee et al., Nat Struct Mol Biol 2019; Nakamura et al., Commun. Biol 2020; Kukimoto-Niino et al., Sci. Adv. 2021)。またクライオ電顕に関わる多くの講演、総説の執筆を行っている(横山武司 生物物理2022; 横山武司 医学のあゆみ2017; 横山武司 実験医学 2017)。
以上のこれまでの研究実績に基づき、田中・横山班では、電子顕微鏡を用いたタンパク質構造解析(ネガティブ染色法、クライオ電顕)に関する広い支援が可能である。
稲葉研究室
稲葉謙次は、これまで大腸菌のペリプラズムや哺乳動物細胞の小胞体ではたらくタンパク質ジスルフィド結合形成および還元に関わる酵素群の構造生化学的解析を中心に研究を進めてきた(Inaba et al., Cell 2006; Inaba et al., EMBO J 2009 &2010; Hagiwara et al., Mol. Cell 2011; Kojima et al., Structure 2014; Maegawa et al. Structure 2017; Okumura et al., Nat. Chem. Biol. 2019; Okumura et al., Structure 2020 etc)。さらに最近では、小胞体とゴルジ体のpHや金属イオンなどの化学環境に依存した新規のタンパク質品質管理機構を発見し(Vavassori et al., Mol. Cell 2013; Watanabe et al., Nat. Commun. 2019 etc)、新たな構造生命科学研究を展開している。それに関連して、小胞体のカルシウム恒常性維持において中心的役割を担うカルシウムポンプSERCA2bのX線結晶構造解析およびクライオ電顕による構造解析において実績がでている(Inoue et al., Cell Reports 2019; Zhang et al., Sci. Adv. 2020; Zhang et al., EMBO J 2021 etc)。
渡部聡は、これまで酸化ストレスセンサー金属タンパク質や、複雑な金属活性中心の生合成に関わるタンパク質群の結晶構造解析を中心とした研究に取り組んできた(Watanabe et al, Mol Cell 2007、Watanabe et al, PNAS 2008&2015、Watanabe et al., Structure 2012, Tominaga et al, PNAS 2013, Kwon et al., PNAS 2018 etc). またタンパク質の品質管理に関わるシャペロンERp44の高分解能結晶構造を決定しpH制御による構造基盤、さらには亜鉛イオンによる新しい品質管理機構を明らかにしてきた(Watanabe et al, PNAS 2017, Nat Commun. 2019)。最近では、クライオ電顕による構造解析にも着手しており、ヒト由来亜鉛トランスポーター(Han et al., bioRxiv 2021)の他、他の金属イオントランスポーターなどのヒト由来膜タンパク質、150kDa程度の比較的小さいタンパク質複合体などの成果を挙げつつある。
以上の研究経緯から、稲葉・渡部班では、大腸菌や酵母での発現が難しい哺乳動物由来のタンパク質(特に膜タンパク質)、金属イオン結合タンパク質、レドックス反応に関わる酵素群等の生産およびクライオ電顕による構造解析においてアドバイスが可能と思われる。